 Revista Científica Revista Científica
Vol. 18. No. 30, p. 1-6 / junio 2018 |
e-ISSN 1998-8850
URL: http://lacalera.una.edu.ni
DOI: https://doi.org/10.5377/calera.v18i30.7732
correo: lacalera@ci.una.edu.ni
|
| Ciencia Animal |
Fermentación en estado sólido de caña de azúcar y harina de hojas de Moringa oleifera para alimentación animal
Solid state fermentation of sugar cane and Moringa oleifera leaf meal for animal feeding
|
|
Nadir Reyes-Sánchez1, Bryan Mendieta-Araica2, Rosario Rodríguez3, Norlan Caldera4
1 PhD en ciencia animal, ORCID: https://orcid.org/0000-0002-5579-9396 / 2PhD en ciencia animal, ORCID: https://orcid.org/0000-0002-8077-7420 / 3 MSc. en agroecología y desarrollo sostenible, ORCID: https://orcid.org/0000-0003-4390-1987
/ 4MSc. en producción animal, ORCID: https://orcid.org/0000-0002-0807-7921 / Autor para correspondencia: nadir.reyes@ci.una.edu.ni. Universidad Nacional Agraria
|
 |
RESUMEN
Se estudió la fermentación en estado sólido de caña de azúcar picada (FESCA) y diferentes niveles (0, 5, 7.5 y 10%) de harina de hoja de Moringa oleifera (HHMO) como fuente proteica en un diseño completamente aleatorizado, con cuatro tratamientos y tres repeti- ciones por tratamiento. Durante el proceso fermentativo, se midió el pH, temperatura ambiente y de fermentación, cada cuatro horas, en cada repetición por tratamiento, durante un período de 36 horas. Se analizó el contenido de materia seca (MS), proteína bruta (PB), Fibra Detergente Neutro (FDN) y la Digestibilidad in vitro de la MS (DIVMS). No se observó efecto estadístico significativo de la temperatura ambiente (28.85 0C ± 3.3), ni de los niveles de inclusión de HHMO sobre la temperatura de fermentación (26.07 0C ± 1.94), ni del pH del producto en fermentación (5.75 ± 0.46). El conte- nido de PB aumenta significativamente (p<0.05) de 12.3 a 24.3% cuando la inclusión de HHMO se incrementó de 0% a 10% y no existe diferencia estadística entre los niveles de inclusión de 5% y 7.5% de HHMO, con 20.8 y 21.4%, respectivamente. La inclusión de HHMO mejora significativamente la DIVMS. Se concluye que la inclusión de HHMO aumenta significativamente el contenido de PB y mejora la DIVMS en la FESCA y que 10% es la proporción más adecuada de HHMO como aditivo para estimular el crecimiento mi- crobiano y su contenido proteico.
Palabras Clave:
proteína bruta, materia seca, fibra detergente neutro, digestibilidad.
Abreviatura: FESCA, fermentación en estado sólido de caña de azucar; HHMO, harina de hoja de Moringa oleifera.
|
ABSTRACT
Solid state fermentation (FES) of the mixture of shredded sugar cane and different levels (0, 5, 7.5 and 10% ) of Moringa oleifera leaf meal (HHMO) as protein source was studied in a completely randomized design, with four treatments and three replicates each one. During fermentative process, pH, environmental and fermen- tation temperature was recorded every four hours in each replicate by treatment during a 36 h period. Dry matter content (MS), Crude protein (PB), Neutral detergent fiber (FDN) and In vitro digestibility of dry matter (DIVMS) were analyzed. No statistical significance was observed for environmental temperature (28.85 0C ± 3.3), nor inclusion levels of HHMO over fermentation temperature (26.07 0C
± 1.94) nor pH of the fermentation product (5.75 ± 0.46). Signifi- cant increase of Crude protein content occurs (P<0.05) from 12.3 to 24.3% when inclusion of HHMO increased from 0% to 10% and no significant differences exist between inclusion levels of 5% and 7.5% of HHMO with 20.8 and 21.4%, respectively. Inclusion of HHMO significantly improves DIVMS even when no significant differences were found in respect to FESCA with 0% of HHMO. It can be conclude that HHMO inclusion significantly increase PB content and improves DIVMS on FES of sugar cane mixtures and 10% in the most adequate proportion of HHMO as additive to stim- ulate microbial growing and it protein content.
Keywords:
raw protein, dry matter, neutral detergent fiber, digestibility.
|
|
E
n Nicaragua y los países tropicales en general, la alimentación de los rumiantes está basada primordialmente en el pastoreo de gramíneas, sin embargo, la producción de pastos no es suficiente para satisfacer los requerimientos
de los animales, principalmente durante el período seco; en este período los animales sufren un estrés nutricional y consecuentemente disminuye la productividad (pérdida de condición corporal debida a la movilización de sus propias reservas, disminución en la producción de leche, acortamiento del período de lactancia, pérdida de peso, ausencia de celo, disminución de la tasa de preñez y en casos extremos la muerte).
El uso de alimentos concentrados no siempre es una opción viable, debido a aspectos relacionados con el precio y la disponibilidad de los mismos, sobre todo para pequeños y medianos productores (Reyes-Sánchez et al., 2009).
La búsqueda permanente de alternativas de solución a la problemática de escasés de pastos durante la épo- ca seca, ha llevado a considerar a la caña de azúcar como una alternativa viable, ya que ofrece variedad de productos y subproductos para la alimentación animal, presentan- do ventajas sobre otros cultivos forrajeros por la cantidad de materia seca que produce y los carbohidratos solubles que acumula con la edad, lo que permite mantener su potencial energético durante el periodo seco, no obstante, su bajo contenido de proteína, su lenta digestión y velocidad de tránsito de la fibra, no permiten optimizar su utilización en la alimentación de rumiantes.
Otra opción es la utilización de árboles y arbustos forrajeros, los cuales tienen gran potencial para mejorar los sistemas de producción animal por su alto rendimiento de forraje, su capacidad de rebrotar y ofrecer forraje de buena calidad en localidades con sequía prolongada (Perdomo, 1991). Moringa oleifera es uno de estos árboles forrajeros que crece bien en todo tipo de suelos desde ácidos hasta alcalinos, es tolerante a la sequía y con alta producción de forraje que se sitúa entre 24 y 99 ton MS/ ha/año, las hojas frescas contienen entre 17 y 24.6% de PB y 2.73 Mcal de EM/kgMS (Reyes-Sánchez et al., 2006), es rico en vitaminas A, B y C, calcio, hierro y en dos aminoácidos esenciales (metionina y cistina) generalmente deficientes en otros alimentos (Makkar y Becker, 1996) y ha sido utilizado en una gran variedad de dietas para distintas especies animales (Reyes-Sánchez et al., 2009; Reyes-Sánchez et al., 2006; Mendieta-Araica et al., 2011; Mendieta-Araica et al., 2010).
Se han desarrollado tecnologías de enriqueci- miento proteico de la caña de azúcar por medio de la fermentación en estado sólido (FES), con las que se obtie- ne un concentrado rico en proteínas a base de levaduras (Elías et al., 1990). En tal sentido, el objetivo del presente trabajo fue evaluar el efecto de diferentes niveles de inclusión de harina de hoja de Moringa oleifera (HHMO) como aditivo en el proceso de fermentación en estado sólido de la caña de azúcar (FESCA) en condiciones comerciales sobre los indicadores fermentativos (temperatura de fermentación y pH) y su composición nutricional (componente proteico, fracción fibrosa y la digestibilidad in vitro de la materia seca).
MATERIALES Y MÉTODOS
Este estudio se realizó en la finca Santa Rosa de la Universidad Nacional Agraria (UNA) en, Managua, Nicaragua, localizada geográficamente a los 12º08’33” de latitud norte y 86º10’31” de longitud oeste. La temperatura media anual es de 26.9ºC, la precipitación histórica de 1
119.8 mm anuales y humedad relativa de 72% (INETER, 2009). Durante la semana en que se efectuó este estudio, la temperatura ambiente osciló entre 24.8 y 34.5ºC, con una humedad relativa entre 39.8 y 69.9% y no hubo precipitaciones.
Se utilizó un diseño experimental completamente al azar, con cinco tratamientos y tres repeticiones. Los tratamientos en estudio fueron:
1. FESCA 0% HHMO: 97.25% caña de azúcar (CA) + 2.25% NNP (urea + sulfato de amonio) + 0.5% sal minero-vitamínica (SMV)
2. FESCA 5% HHMO: 84.25% CA + 5% HHMO
+ 5% pulidura (PU) + 3% melaza (MEL) + 2.25% de NNP + 0.5% SMV
3. FESCA 7.5% HHMO: 81.75% CA + 7.5% HHMO + 5% SE + 3% MEL + 2.25% NNP+ 0.5% SMV
4. FESCA 10% HHMO: 79.25% CA + 10% HHMO + 5% SE + 3% MEL + 2.25% NNP + 0.5% SMV
Los tratamientos fueron preparados utilizando tallos limpios de caña de azúcar (sin hojas, sin paja y sin cogollos) de una variedad comercial no identificada, con doce meses de edad. Los tallos se cosecharon con machete y se procesaron con una picadora mecánica para obtener un tamaño de partículas de 2 mm. La caña picada, fue distribuida sobre una superficie lisa de cemento, el espesor de la capa era de 10 centímetros. Se preparó una mezcla de dos fuentes de NNP y sal minero-vitamínica, la que se distribuyó de manera uniforme sobre la caña de azúcar pica- da, además se le agregó pulidura y melaza diluida en agua. Posteriormente se agregó la HHMO según lo correspondiente a cada tratamiento. Todos los componentes mencionados se mezclaron homogéneamente, con la ayuda de un rastrillo forrajero.
Cada tratamiento consistió en un lote de 30 kg, dividido en tres repeticiones de 10 kg cada una, las que se extendieron en un piso de cemento que se encontraba bajo sombra,
con espesor de capa de 10 cm para garantizar las condiciones
aeróbicas necesaria para que se dé la fermentación.
Se estableció un período para el proceso de fermentación en estado sólido de 36 h. A las cuatro horas
de iniciado el proceso de fermentación se removió cada
mezcla para favorecer el proceso de FES. Se midió la temperatura ambiente y la temperatura de fermentación de
cada repetición por tratamiento cada cuatro horas. Simultáneamente se midió el pH, utilizando un pH/temperature
meter, model pH55/ph56 pocket size con electrodo reemplazable, marca pH Martini Instruments by Milwaukee
Instruments, Inc
Al inicio y al final del proceso fermentativo, se
recolectaron muestras aleatorias de cada repetición por
tratamiento con un peso fresco de 200 gramos para determinar el contenido de MS. Al finalizar la fermentación, el
material de cada repetición por tratamiento se dispersó, en
capas delgadas de dos cm de alto, para secarlo al sol sobre
una superficie de cemento y se revolvió cada dos horas.
Una vez seco, se tomaron muestras aleatorias de 100 g de
cada repetición por tratamiento. En éstas se determinó el
contenido de Proteína Bruta (N x 6.25) usando el método
de Kjeldahl AOAC (1984), el contenido de Fibra Neutro
Detergente fue analizado según lo descrito por Van Soest
et al., (1991) utilizando sulfito de sodio. Además, se determinó la Digestibilidad in vitro de la Materia Seca (DIVMS) usando el método in vitro modificado de una etapa
(VOS) (Mbwile y Udén, 1991)
A los datos se les realizó análisis de varianza (ANDEVA) para determinar el efecto de los tratamientos sobre
las variables estudiadas usando el Modelo Lineal General
(GLM) por el procedimiento del Software Minitab Statistical
Versión 16.0 (Minitab, 2014). Las comparaciones de medias
se realizaron por el procedimiento de Tukey cuando las diferencias entre las medias eran significativas (p < 0.05)
|
RESULTADOS Y DISCUSIÓN
Según Vivas y Carvajal (2004) la FES se desarrolla a partir
de la microflora epifítica (levaduras y bacterias) presente
en la caña de azúcar, los que se nutren de los azúcares presentes y cuya reproducción y desarrollo se favorece mediante el enriquecimiento del medio de cultivo con los nutrientes requeridos por estos microorganismos y el control
que se ejerce sobre el pH y la temperatura de fermentación,
igualmente reportan Candida y Saccharomyses como los
dos grandes grupos de microrganismos intervinientes en la
fermentación de la caña de azúcar, siendo la Candida pentolopesii la que constituye hasta el 37% de la población
microbiana total y junto con la Saccharomyses cereviciae
(35%) completan más del 70% de la totalidad de microorganismos presentes en la fermentación de la planta.
La levadura Saccharomyces cerivisiae es un microrganismo unicelular de fácil cultivo, con gran velocidad de división celular (aproximadamente dos horas). Sus
colonias pueden crecer y madurar en tres días y tienen un
color amarillento oscuro. Para su reproducción necesitan
fuentes de carbono (glucosa, fructosa, celulosa, manosa,
galactosa maltosa, sacarosa, rafinosa, entre otros), fuentes
de nitrógeno (orgánico e inorgánico), fuentes de fósforo,
vitaminas y distintos elementos traza.
Temperatura ambiente y temperatura de fermentación.
El significado de la temperatura en el desarrollo de
un proceso biológico puede determinar efectos tan importantes como la desnaturalización de proteínas, inhibición
de un metabolito o bien la muerte de células. El control de
la temperatura es uno de los factores que decide el buen
desarrollo de la fermentación en estado sólido y deberá ser
tomado en cuenta cuando algún proceso de FES se diseñe
(Becerra, 2006).
El control de la temperatura ambiente y de fermentación (cuadro 1) mostró que, aunque la temperatura
ambiente tuvo una variación de aproximadamente 10 °C
entre sus valores extremos, los valores de la temperatura
de fermentación fueron más estables con sólo 5.9 °C de
diferencia, durante todo el proceso de FES
|
 |
|
No se observó efecto estadístico significativo
de la temperatura ambiente promedio (28.85 0C ± 3.3),
ni de los niveles de inclusión de HHMO sobre la temperatura promedio de fermentación (26.07 0C ± 1.94). Los
resultados indican que durante el proceso de FESCA con
HHMO, hay una tendencia natural a que se mantenga la
temperatura interna de fermentación del producto con una
estabilidad relativa. Estos resultados coinciden con los reportados por Ruíz et al., (2002). Así, para las condiciones
de este experimento, con una temperatura ambiente entre
24.8 y 34.5 °C la temperatura de fermentación sólo varió
en un rango de 23.2 a 29.1 °C a medida que avanzó la fermentación (cuadro 1)
El rango óptimo para el crecimiento de levaduras
es de 30 °C (Becerra 2006), aunque en la fermentación de
caña de azúcar se han reportado temperaturas de 30 a 33
°C (Lescano y Elías, 1992). Como se puede observar en
la FESCA con HHMO (figura 1) durante las 36 horas, la
temperatura de fermentación fue siempre menor a 30 °C e
inferior a la temperatura ambiente
Estos datos sugieren un ligero efecto de la temperatura ambiente sobre la temperatura de FESCA con
HHMO, lo cual puede ser un factor importante a tener en
cuenta para su elaboración en condiciones comerciales de
producción durante las horas del día al aire libre, indicando que eventualmente no sería posible debido a que la acción conjunta de una mayor temperatura ambiente y de la
radiación solar inhibirían la acción microbiana en la que
se fundamenta el proceso. El proceso de secado natural
relativamente rápido, de la FESCA con HHMO, que se
produce durante la exposición a los rayos solares parece
confirmar esta observación.
|
 |
|
Humedad. La humedad es un factor intrínsecamente ligado a la FES y con las particularidades del material bioló-
gico. La importancia del agua en el sistema es debido al
hecho que la mayoría de las células viables se caracterizan
por un contenido de humedad entre 70 y 80%. En este sentido, para el caso de bacterias, la humedad en el material
deberá ser más del 70%; para las levaduras el rango puede
ser entre 60 y 70%, y para los hongos, entre 20 a 70%
(Becerra, 2006).
Es importante destacar que durante el proceso de
FESCA con HHMO (36 horas) el contenido de humedad
estuvo entre 70.9 y 57.3% (figura 2), en el rango de lo
recomendado para la reproducción y crecimiento de levaduras. Se observa que la FESCA con 0% HHMO presenta un mayor contenido de humedad inicial que la FESCA
con 5, 7.5, y 10% HHMO, probablemente debido a que a
la adición de HHMO al ser un material seco, disminuye
el contenido de humedad de las mezclas. No obstante, es
importante resaltar que en todos los tratamientos ocurren
mermas o pérdidas en el contenido de humedad, posiblemente debido a la evaporación de parte de la humedad
del producto durante las 36 horas de fermentación por el
efecto combinado de la temperatura y la humedad relativa
ambiental,
Potencial de iones hidrógeno (pH).
El pH es otro de los
factores importantes en el proceso de fermentación. Cada
microorganismo posee un rango de pH para su crecimiento y actividad con un valor óptimo dentro del rango. En
general se ha observado que los hongos tienen rangos de
crecimiento entre 3.5 y 6.0, las levaduras de 4.5 a 7.0 y las
bacterias un poco más arriba que las levaduras sin que esto
pueda ser tomado como una regla (Becerra, 2006)
|
 |
 |
|
En el cuadro 2 podemos observar que el pH del
proceso de FESCA con diferentes niveles de HHMO durante las 36 horas se mantuvo en un rango de 5.03 y 6.63
con un promedio de 5.75 ± 0.46 acorde con lo recomendado para la reproducción de hongos y levaduras,
No se observó efecto significativo de la temperatura ambiente (28.85 0C ± 3.3), ni de los niveles de inclusión de HHMO sobre el pH del producto en fermentación (5.75 ± 0.46). Al igual que el experimento reportado
por Ruíz et al., (2002), el pH durante el proceso de FES
muestra un comportamiento más independiente con respecto a la temperatura ambiente y los niveles de inclusión
de HHMO en las diferentes horas, ya que se inició con
un valor promedio de 5.56 el que incrementó ligeramente a 6.5 a las 8 horas de fermentación y luego descendió
nuevamente manteniéndose uniforme hasta el final con un
valor promedio de 5.56 a las 36 horas. Desde el punto de
vista fermentativo, este resultado sugiere la presencia de
condiciones favorables para el crecimiento microbiano,
facilitadas por los aditivos utilizados.
Hay algunas diferencias acerca del pH de la FESCA con HHMO cuando se compara con el proceso fermentativo de saccharina rústica, reportadas por otros autores. Elías et al., (1990) reportan valores de pH entre 4.4 y
4.5 que resultan muy inferiores al medido en este experimento, pero estos autores trabajaron con frascos Roux de laboratorio. Valiño et al., (1996), al trabajar con cámaras
de ventilación forzada y temperaturas entre 42.1 y 49.3
°C, registraron valores de pH entre 5.4 y 5.7, que sí se
encuentran en el rango hallado en este estudio.
Contenido de proteína bruta (PB), fibra detergente
neutro (FDN) y digestibilidad in vitro de la materia
seca (DIVMS).
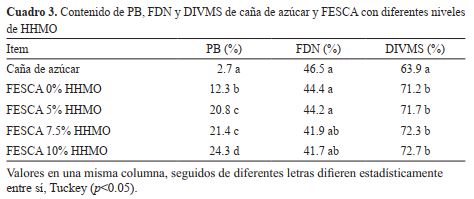
El contenido de proteína bruta del tallo
limpio de la caña de azúcar incrementa significativamente
(p < 0.05%) de 2.7% a 12.3% de PB y la DIVMS de 63.9
a 71.2%, mediante el proceso de fermentación en estado
sólido con 0% de harina de hoja de Moringa oleifera (cuadro 3). Estos resultados están en el rango de valores reportados por otros autores, y se ubican entre 9.76 y 15.58 %
de PB (Elías et al., 1990; Valdivié et al., 1997; Neto et al.,
2001). Estos autores aducen que algunos de los posibles
factores que influyen en la obtención de diferentes niveles
de PB en la FES de la caña de azúcar pueden ser el clima,
la variedad de la caña de azúcar, el suelo y la época.
El contenido de proteína bruta en la FESCA aumenta significativamente (p<0.05) de 12.3 a 24.3% cuando la inclusión de HHMO se incrementó de 0% a 10% y
no existe diferencia estadística entre los niveles de inclusión de 5% y 7.5% de HMO, con 20.8 y 21.4%, respectivamente (cuadro 3).
La inclusión de diferentes niveles de HHMO
mejora significativamente la DIVMS, al comparar con la caña de
azúcar, aunque no se encontraron
diferencias significativas con el
nivel de 0% de HHMO. Se observa una disminución significativa
en el contenido de FDN al agregar
HHMO, sin embargo, las diferencias no clasifican claramente de
acuerdo a los niveles de inclusión
de HHMO estudiados (cuadro 3).
|
 |
CONCLUSIONES
La inclusión de harina de hoja de Moringa oleifera como
aditivo al proceso de fermentación en estado sólido de la
caña de azúcar aumenta significativamente (p<0.05) el
contenido de proteína bruta de 12.3 a 24.3% cuando la
inclusión de harina de hoja de Moringa oleífera se incrementó de 0% a 10%, mejora significativamente la digestibilidad in vitro de la materia seca, disminuye el contenido de fibra detergente neutro y no tiene efecto significativo
sobre la temperatura de fermentación (26.4 0C ± 2.48) y
el pH (5.69 ± 0.48) del producto en fermentación. Se recomienda la inclusión de HHMO al 10% como la proporción
más adecuada para estimular el crecimiento microbiano y
aumentar su contenido proteico, sin afectar los patrones
fermentativos de la FES de la caña de azúcar
|
REFERENCIAS BIBLIOGRÁFICAS
AOAC (Association of official analytical chemists). 1984. Official methods of analysis. 14 ed. Washington, US
Becerra B, A. 2006. Aprovechamiento de subproductos de manzana mediante la producción de proteína microbiana con fermentación en
estado sólido para la alimentación animal. Tesis para obtener el grado de Doctor in Philosophia. Universidad Autónoma de Chihuahua,
Facultad de Zootecnia, Secretaría de Investigación y Posgrado. 107 páginas
Elías, A; Lezcano, O; Lezcano, P; Cordero, J; Quintana, L. 1990. Reseña descriptiva sobre el desarrollo de una tecnología de
enriquecimiento proteico de la caña de azúcar mediante fermentación en estado sólido saccharina. Revista Cubana de Ciencia
Agrícola. 24:3-12.
INETER (Instituto Nicaragüense de Estudios Territoriales). 2009. Informe meteorológico. Estación Aeropuerto Inter nacional ‘‘Augusto
Cesar Sandino’’, Código 69027. Las Mercedes, Managua, NI
Lescano, O; Elías, A. 1992. Efecto de la temperatura y la urea en la fermentación de la caña de azúcar para producir saccharina. Revista
Cubana de Ciencia Agrícola. 26:291-296
Makkar, H; Becker, K. 1996. Nutritional value and antinutritional components of whole and ethanol extracted Morin ga oleifera leaves.
Anim. Feed Sci. Technol. 63:211–228.
Mbwile, R; Udén, P. 1991. Comparison of laboratory methods on precision and accuracy of predicting forage organic m a t t e r
digestibility. Animal Feed Science and Technology. 32(4):243-251.
Mendieta-Araica, B; Sporndly, E; Reyes-Sánchez, N; Sporndly, R. 2011. Feeding Moringa oleifera fresh or ensiled to cows, effects on
milk yield and milk flavor. Tropical Animal Health and Production 43:1039–1047
Mendieta-Araica, B; Sporndly, R; Reyes-Sánchez, N; Norell, L; Sporndly, E. 2010. Moringa (Moringa oleifera) leaf meal as a source
of protein in locally produced concentrates for dairy cows fed low protein diets in tropical areas. Livestock Science Vol. 137:10-17
Minitab. 2014. Minitab User’s Guide 2. Data Analysis and Quality tools, Release 16 for Windows, Minitab Inc. Pennsylvania, USA
Neto, AI; Pereira De Rezende, CA; Cruz, V; Torres, DM. 2001. Desempeño de novillos mestizos en confinamiento alimentados con
ensilado mixto y Saccharina. Revista Cubana Ciencia Agrícola. 35:19-24.
Perdomo, P. 1991. Adaptación edáfica y valor nutritivo de 25 especies y accesiones de leguminosas arbóreas y arbustivas en dos suelos
contrastantes. Tesis de Zootecnia, Universidad Nacional de Colombia, Facultad de Ciencias Agropecuaria. Palmira, CO. 128 p
Reyes Sánchez, N; Mendieta Araica, B; Fariñas, T; Mena, M; Cardona, J; Pezo, D. 2009. Elaboración y utilización de ensilajes en la
alimentación del ganado bovino. Serie técnica, Manual técnico / CATIE N° 91. Managua, NI. 98 p.
Reyes Sánchez, N; Rodríguez, R; Mendieta Araica, B; Mejía Sovalbarro, L; Mora Taylor, A. 2009. Efecto de la suplementación con
Moringa oleífera sobre el comportamiento productivo de ovinos alimentados con una dieta basal de pasto guinea (Panicum maximun
Jacq.).La Calera 9(13):60-69.
Reyes-Sánchez, N; Ledin, S; Ledin, I. 2006. Biomass production and chemical composition of Moringa oleifera under different
management regimes in Nicaragua. Agroforestry Systems 66:231–242
Ruíz, C; Ruíz, M; Ruíz, G; Torres, V. 2002. Efecto de la inclusión de sulfato de amonio en el aditivo para la elaboración de Saccharina
rústica. Revista Cubana de Ciencias Agrícolas. 36(2):153-158.
Valdivié, M; González, LM; Elías, A. 1997. Nuevos tipos de Saccharina para aves. Rev. Cubana Ciencias Agríc. 30:189-194
Valiño, E; Elías, A; Álvarez, E; Albelo, N. 1996. Caracterización del funcionamiento de la cámara de fermentación para la producción de
saccharina. Revista Cubana Ciencia Agrícola. 30:67-72
Van Soest, P; Robertson, J; Lewis, B. 1991. Methods for dietary fiber, neutral-detergent fiber and non-starch polysaccharides in relation
to animal nutrition. J Dairy Sci 74:3583–3597.
Vivas, NJ; Carvajal, J. 2004. Rustic saccharine, a biotechnological application for animal feeding. Rev. Facultad de Ciencias Agropecuarias
2(1):43-48.
|
Recibido: 22 de marzo de 2018
Aceptado: 4 de junio de 2018
|
 |