 Revista Científica Revista Científica
Vol. 19. No. 32, p.1-7 / junio 2019 |
e-ISSN 1998-8850
URL: http://lacalera.una.edu.ni
DOI: https://doi.org/10.5377/calera.v19i32.8434
correo: lacalera@ci.una.edu.ni
|
| Recursos Naturales y Ambiente |
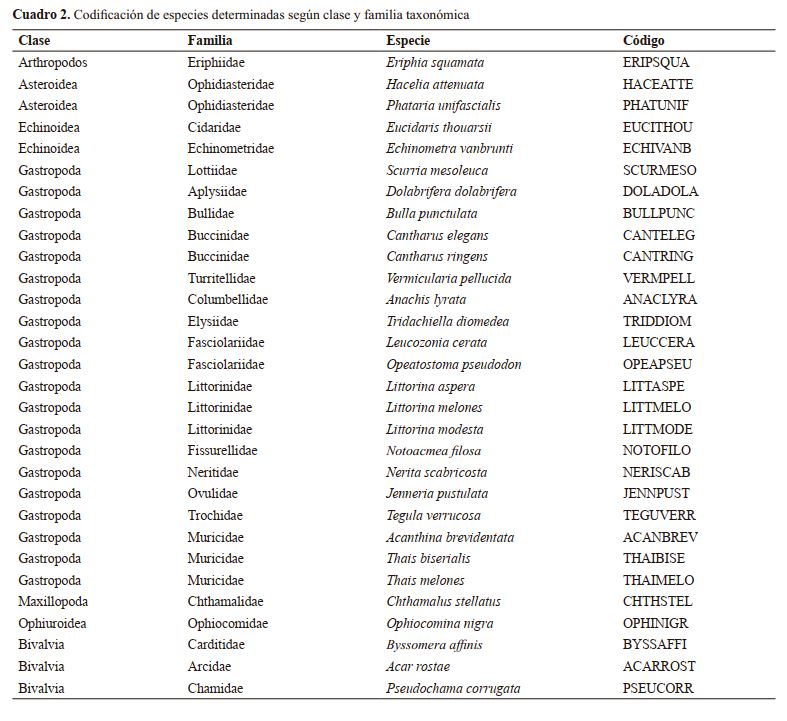
Macroinvertebrados intermareales y su asociación con tres tipos de microhábitats en el Refugio de Vida Silvestre Río Escalante – Chacocente, Carazo, Nicaragua
Intertidal macroinvertebrates and their association with three types of microhabitat at the Refugio de Vida
Silvestre Río Escalante – Chacocente, Carazo, Nicaragua
|
|
Miguel Garmendia-Zapata, Rosa María Reyes P.
Docentes Investigadores, ORCID: https://orcid.org/0000-0002-9080-7670, garmendiaz@ci.una.edu.ni
Facultad de Recursos Naturales y del Ambiente, Universidad Nacional Agraria.
|
 |
RESUMEN
Las comunidades de macroinvertebrados son de mucha importancia, pues tienen un rol ecológico imprescindible como parte del
engranaje biótico de las zonas intermareales. El presente estudio
se realizó en el Refugio de Vida Silvestre Río Escalante – Chacocente en Carazo, Nicaragua, donde se caracterizaron y compararon
parámetros de biodiversidad (riqueza de especie y abundancia) y
composición de especie entre tres tipos de microhábitats (aglomeraciones de rocas) definidos por la forma de las rocas que los conforman. Como resultado se contaron 1 808 individuos, 30 especies,
26 géneros, 24 familias y siete clases. Las especies más abundantes
según el número de individuos fueron en principio: Nerita scabricosta (175 individuos), Littorina aspera (162), Acar rostae (153),
Byssomera affinis (117), Eriphia squamata (110) y Anachis lyrata
(106). El microhábitat denominado Peñas, fue el significativamente
más rico y donde se determinó mayor abundancia; sin embargo, la
composición de especie comparada entre los microhábitat no difirió
significativamente, pero sí entre las parcelas individuales, siendo la
parcela denominada Peña 1, la que presentó tipos de especies diferentes y en mayores abundancias en comparación con el resto de las
parcelas.
Palabras Clave: biodiversidad, ecológico, composición de especies.
|
ABSTRACT
The macroinvertebrate communities are very important because
they have an essential ecological role as part of the biotic gear of the
intertidal zones. The present study was conducted at the Refugio de
Vida Silvestre Río Escalante – Chacocente where biodiversity parameters (richness of species and abundance) and species composition
were characterized and compared among three types of microhabitats (rock agglomerations) defined by the form of the rocks that
make them up. As a result, 1 808 individuals, 30 species, 26 genera,
24 families and seven classes were observed. The most abundant
species according to the number of individuals were: Nerita scabricosta (175 individuals), Littorina aspera (162), Acar rostae (153),
Byssomera affinis (117), Eriphia squamata (110) and Anachis lyrata
(106). The microhabitat called Peñas, was significantly richer and
where greater abundance was determined; however, the composition of the species compared among the microhabitat did not differ significantly, but differences were noted between the individual
plots, the plot called Peña 1, presented different types of species and
greater species abundances compared to the remaining plots
Keywords:Biodiversity, ecological, species composition
|
|
L
os hábitats en los litorales rocosos son impor tantes ecológicamente (Crowe, Thompson, Bray y Howkins, 2000), dado la diversidad de vidas que alberga, entre ellas la diversidad de la comunidad de macroinvertebrados -
intermareales. Estos organismos viven entre los
microhábitat que le ofrece las aglomeraciones rocosas a orilla de la playa, influenciados por diversos factores ambientales, incluyendo la influencia
de actividades humanas.
Aunque en Nicaragua se han realizado
trabajos relacionados a ciertos grupos macroinvertebrados, en especial relacionados con moluscos
(Guevara, López y Pérez, 1997; Pérez y López,
2002; Pérez, Sotelo y Arana, 2004; Pérez, Sotelo, Gámez, Aburto y Siria, 2007), es muy poca (o
casi ninguna) la información que se encuentra en
la literatura (al menos en publicaciones formales)
sobre análisis de comunidades intermareales y su
relación con su hábitat; siendo meritorio aportar
al conocimiento en esta temática, con el presente
estudio se pretende determinar el cómo está constituida la diversidad de invertebrados epibentónicos
dentro del área de muestreo, lo que incluye el conteo de las especies observadas, la estimación de las especies
esperadas y una comparación entre la riqueza de especies y
abundancia entre los microhábitats; y determinar diferencias
en términos de composición de especies entre microhábitats
y entre unidades de muestreo
Los resultados de este estudio servirán de base e
inspiración para otros estudios que involucren análisis ecoló-
gico de la comunidad de macroinvertebrados intermareales,
tomando en cuenta que estos pueden potencialmente ser utilizados como bioindicadores en programas de monitoreo de
cambio ecológico por acción antropogénica (Ikomi, Arimoro
y Odihirin, 2005). Ampliar los conocimientos en esta área se
ha vuelto imperativo para la toma de decisiones ante efectos relacionados con la introducción de especies invasivas, el
cambio climático global (Trott, s.f.) o local
MATERIALES Y MÉTODOS
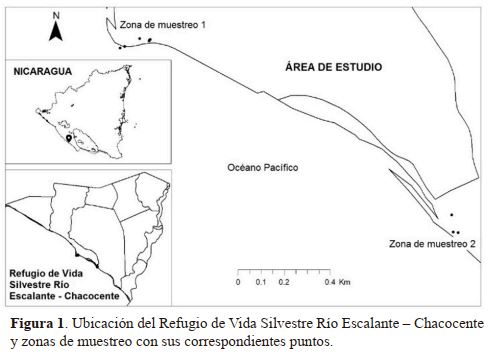
Descripción del sitio. El área de estudio corresponde a la
zona costera del Refugio de Vida Silvestre Río Escalante –
Chacocente, ubicado a 122 km de la ciudad de Managua,
entre los departamentos de Carazo y Rivas entre las coordenadas 11°30ʹ33ʺ Norte y 86°14ʹ43ʺ Oeste (Figura 1). El refugio tiene una extensión territorial de 4 645 ha, (46.45 km2)
que incluye la zona costera, zona de transición y un extenso
bosque tropical seco (MARENA, 1999). El clima corresponde a un bosque tropical seco, según sistema de clasificación
de Holdridge (1978). Se registran temperaturas promedio de
26°C; precipitaciones promedio de 1 000 mm anuales con un período marcadamente seco desde febrero a abril, el periodo
lluvioso está dado entre junio y octubre. Las zonas más altas
alcanzan elevaciones de hasta 400 m.s.n.m. y pendientes entre 0-75 %. De manera general predominan los tipos de suelo
vertisoles y coluviales (MARENA, 2002).
|
 |
|
Proceso metodológico.
Toma de datos. La información se registró en tres tipos de
aglomeraciones rocosas (microhábitat) denominados, en este
estudio, por los aspectos morfológicos de las rocas que los
componen: 1) sistema formado por peñas (grupos de rocas
grandes: de hasta 10 m de diámetro, amorfas y angulares); 2)
sistema formado por grupos de rocas pequeñas (0.2 – 2 m) y
redondas; y 3) sistema formado por grupos de rocas pequeñas
(0.2 – 0.5 m) planas y dispuestas en forma laminar. En delante denominaremos a estos microhábitats como: peñas, redondo y laminar respectivamente, como nombres abreviados. El
tamaño de estos sistemas oscilaba entre 5 – 50 m.
Los tres tipos de aglomeraciones rocosas se seleccionaron aleatoriamente y de igual forma se establecieron
tres unidades de muestreo en cada una, las parcelas con nú-
meros 1 y 2 se establecieron en la zona de muestreo 1 y las
parcelas con números 3 se establecieron en la zona de muestreo 2. Estas parcelas consistían en parcelas circulares de un
metro de radio, dentro de dicha parcela se contaron todos los
individuos invertebrados ≥ 0.5 cm de longitud. Dos especí-
menes de cada especie fueron colectados e identificados en el
Centro de Malacología y Diversidad Animal de la Universidad Centroamericana (UCA).
Análisis de la información.
En principio se realizó una descripción general de la diversidad de macroinvertebrados dentro del área de muestreo, la cual consistió en hacer recuento
de abundancia total; conteo del número de especies y su distribución taxonómica; y selección de las especies, familias
y clases más representativas. Se elaboró una curva de acumulación de especies para toda el área de estudio, reflejando
el número de muestras versus el número de especies. Este
análisis se realizó a fin de determinar la representatividad del
número de especies acumuladas en relación al esfuerzo de
muestreo. Para soportar los resultados visualizados en la curva de acumulación de especie se calculó el Estimador Chao 1.
Los procedimientos e interpretaciones de los resultados tanto
de la curva de acumulación de especies como del Estimador
Chao 1 se basaron en Magurran (2004); los análisis se realizaron en el programa PAST 3.12, la curva se elaboró en
Microsoft Excel.
Seguidamente se realizó una comparación pareada
de los tres microhábitat en términos de la riqueza y la abundancia. Las comparaciones de la riqueza se realizaron con
permutación y las comparaciones de la abundancia con una
prueba t con permutación en el programa PAST 3.12.
La relación de la composición de especies con los
microhábitats fue explorada en una ordenación llamada Escalamiento Multidimensional No-Métrico (McCune y Grace, 2002; Borcard, Gillet y Legendre, 2011) o NMS por sus
siglas en ingles. Para explorar diferencias significativas en
términos de composición entre los microhábitats se utilizó
el Procedimiento de Permutación Multirespuesta (MRPP por
sus siglas en inglés) (McCune y Grace, 2002) con distancia
Euclidiana.
El MRPP provee un valor A útil para determinar
cuan similar son las unidades de muestreo entre cada grupo.
Cuando la heterogeneidad entre grupos fue igual a lo esperado por chance A = 0; si las observaciones dentro de los grupos
fueran idénticas, A = 1; cuando hay más heterogeneidad entre
grupos que la esperada por chance, A < 0. Adicionalmente, un
valor de p es proveído para evaluar la probabilidad de observar diferencias por chance. De las 30 especies, solamente 17
se seleccionaron para ser parte de los análisis multivariados,
debido a la poca representatividad de las restantes 13 (observadas una vez y/o en una parcela), de tal forma que la matriz
utilizada estaba conformada por nueve filas representando a las unidades de muestreo y 17 columnas en donde
estaban los datos de abundancia de cada especie.
Las diferencias en la composición de especies
entre parcelas, incluyendo tipos de especies y abundancia, se llevaron a cabo con un Mapa de Calor con doble
análisis de conglomerado, distancia Euclideana y utilizando el método de Conglomerado de Varianza Mínima
de Ward. El análisis de conglomerado del eje X agrupaba las parcelas etiquetadas con los nombres de los microhábitats más el número de cada parcela y el análisis
de conglomerado del eje Y agrupaba las especies con
sus nombres científicos codificados. El Mapa de Calor
con los análisis de conglomerado y la ordenación NMS se realizaron con el programa R 3.5.1 y los paquetes MASS
(Ripley et al. 2018), Vegan (Oksanen et al. 2018) y Pheatmap
(Kolde, 2018). El análisis MRPP se realizó en el programa
PCORD 6.08
|
RESULTADOS Y DISCUSIÓN
Descripciones generales de diversidad de invertebrados.
En el área muestreada se contaron un total de 1 808 individuos, distribuidos en 30 especies, 26 géneros, 24 familias y
siete clases. Las especies más abundantes según el número
de individuos fueron en principio: Nerita scabricosta (175
individuos), Littorina aspera (162), Acar rostae (153), Byssomera affinis (117), Eriphia squamata (110) y Anachis lyrata (106); seguidos de: Opeatostoma pseudodon (93), Thais
melones (90), Leucozonia cerata (83), Cantharus ringens
(80), Acanthina brevidentata (71), Jenneria pustulata (68),
Pseudochama corrugata (64), Thais biserialis (59) y Agathistoma verrucosa (55).
Para el resto de las especies se registraron menos de
50 individuos. Las especies reportadas solamente una vez en
el área de estudio fueron: Eucidaris thouarsii, Hacelia attenuata, Phataria unifascialis y Tridachiella diomedea.
Las familias más representadas según el número
de especies fueron: Littorinidae (3 especies), Muricidae (3),
Buccinidae (2), Fasciolaridae (2) y Ophidiasteridae (2). Las
clases más representadas según el número de especies fueron: Gastropoda (20), Pelecypoda (3), Asteroidea (2) y Echinoidea (2). El resto de las familias y clases fueron representadas por una especie.
La comunidad de macroinvertebrados intermareales
está bien representada en este muestreo, sin embargo, aún
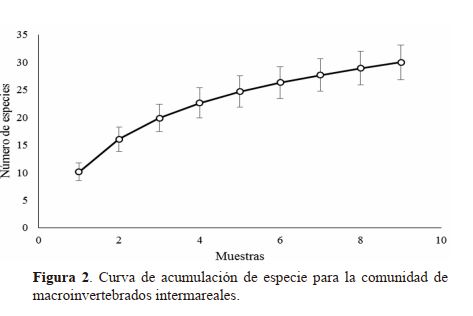
hay especies por encontrar en este ecosistema. En la figura 2
se observa la curva de acumulación de especies con una leve
inclinación y con intervalos de confianza ampliándose hacia
el final de la curva, indicando que no ha alcanzado su nivel
asintótico, este hecho sugiere que más esfuerzo de muestreo
es necesario para completar la lista de especies de este grupo
de organismos en el refugio.
|
 |
|
De hecho, el Estimador Chao 1 sugiere que se deberían encontrar aproximadamente 39 especies, si se restan
las especies observadas se concluye que probablemente seis
especies aún restan por determinar. Básicamente se ha determinado el 84.6% de la riqueza existente en este ecosistema.
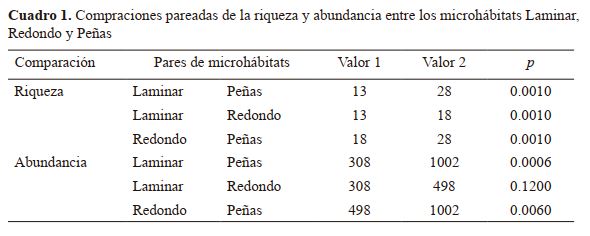
Comparación de la diversidad de especie entre microhábitats. La mayor cantidad de especies de macroinvertebrados
fueron observadas en el microhábitat denominado Peñas con
28 especies, seguido del microhábitat denominado Redondo
(18) y el microhábitat llamado Laminar (13), las diferencias
de las comparaciones son significativas (p=0.01) (Cuadro 1).
En términos de abundancia, en el microhábitat Pe-
ñas se determinó la mayor cantidad de individuos (1 002), en
relación a Redondo (498) y Laminar (308). Las diferencias
entre la comparación de la abundancia de Peñas con Redondos y Laminar resultaron significativas (p=0.006 y p=0.0006
respectivamente); mientras que la comparación entre Redondo y Laminar no fue significativa (p=0.12). El Valor 1 y Valor
2 representan el valor de la riqueza y abundancia respectiva
de cada par de microhábitat. El valor de p para la riqueza
proviene de una prueba de permutación y el valor de p para la
abundancia proviene de una prueba t con permutación.
|
 |
|
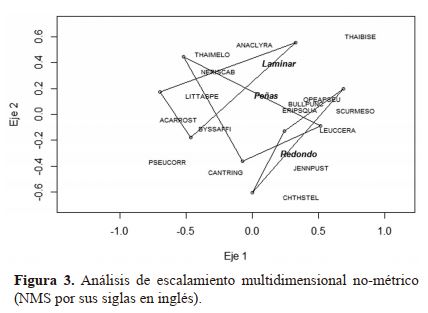
Relación de la composición de especies con los microhábitats. Las relaciones entre la composición de especies entre
los tres microhábitat fue explorada primeramente mediante la ordenación Escalmiento Multidieinsional No-Métrico
(NMS) con distancia Bray-Curtis. Para esta ordenación se
obtuvo una solución bidimensional con 0.093 de estrés (ajuste aceptable) y 20 interaciones
En la ordenación se muestran tres componentes: 1)
Las parcelas, representadas con puntos huecos; 2) Las especies, con las etiquetas de sus nombres científicos codificados;
y 3) Los polígonos que encierran a las parcelas agrupadas por
el nombre de los microhábitats (Figura 3)
En la figura 3 se presenta una ordenación NMS que
incluye las parcelas por microhábitat; las especies con sus
nombres científicos codificados (Cuadro 2); y los microhá-
bitat representados por los polígonos; en la cual no se logra evidenciar una clara separación de la composición de los tres
microhábitats, esto es notorio ya que los tres polígonos se
superponen, trayendo consigo la sospecha de que los tres microhábitats tienen composición similar. El NMS es un
análisis exploratorio global para visualizar las relaciones, en
términos de inferir diferencia entre los tres microhábitats y
de evaluar la verdadera asociación
de las especies a cada uno de ellos,
se utilizó la prueba Procedimiento de Permutación Multirespuesta
(MRPP).
|
 |
|
Se comparó la composición de especies de los tres microhábitats utilizando el MRPP. Como
resultado se obtuvo un valor de A
de 0.026 y un valor de p = 0.30,
por tal razón se falla en rechazar la
hipótesis nula que denota igualdad
composicional y se concluye que
no hay evidencias suficientes para probar que la composición de especies comparada entre los tres microhábitats es
diferente.
Consecutivamente se realizó la prueba pareada entre
los microhábitat, para los cuales se compararon Laminar versus Peñas, Laminar versus Redondo y Peñas versus Redondo.
Como resultado, no se determinaron diferencias significativas para ninguna comparación (p = 0.073; p = 0.47; p = 0.62,
respectivamente). A pesar que se determinaron diferencias
significativas entre los tres microhábitats en términos de riqueza y abundancia (excepto para Laminar versus Redondo),
la composición de especies resultó ser similar entre ellos. O
sea que las comunidades de macroinvertebrados no tienen
una especificidad en asociarse a alguno de los microhábitat;
por consiguiente, no se pueden determinar especies asociadas
a cada uno de ellos.
|
 |
|
A pesar que no se determinó diferencia alguna en
términos de composición de especie de macroinvertebrados
al ser comparada entre los tres microhábitats, se determinó
cierta diferencia de la composición entre parcelas. Esto se
visualiza en el Mapa de Calor con doble análisis de conglomerados con distancia Euclideana y el método de varianza
mínima de Ward (Figura 4). Uno de los análisis de conglomerado aglomera a las parcelas que están etiquetadas por
microhábitat y número de parcela (Eje X) y el otro análisis
que aglomera las especies (Eje Y). En el Mapa de Calor los valores de la abundancia están en función del tono de color
gris, siendo los tonos más oscuros los más abundantes y los
más claros los menos abundantes.
|
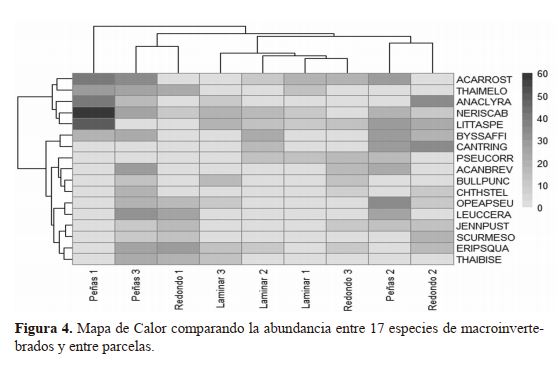 |
|
La composición de especies de macroinvertebrados al ser comparada entre unidades de muestreo dejan clara
una diferencia en composición de especie que no obedece
a los tipos de microhábitats (a como concluimos anteriormente) sino que, a las parcelas en sí, pudiendo estar siendo
influenciada la composición de especies por efecto bióticos
o abióticos localizado. La parcela más diferente fue la llamada Peñas 1, pues en ella se aglomera la abundancia de cinco
especies: ACARROST, THAIMELO, ANACLYRA, NERISCAB y LITTASPE; especialmente para estas dos últimas los
valores de abundancia son extraordinariamente altos (50-60
individuos) en esta parcela (ver tonos de grises en la rejilla
del Mapa de Calor) en comparación con el resto. Estas características hacen de la parcela Peñas 1 una unidad de muestreo
con considerable diferencia en términos de composición.
Consecutivamente se observa la agrupación de las
parcelas Peñas 3 y Redondo 1, las cuales se caracterizan específicamente por la ausencia de las especies LITTASPE,
CANTRING y PSEUCORR, de las cuales LITTASPE fue
una de las especies más abundantes en la parcela Peñas 1. Las
parcelas Peñas 3 y Redondo 1 presentaron mayor abundancia de ERIPSQUA, LEUCCERA, THAIMELO y THAIBISE
(44-56 individuos). Aunque ambas parcelas se diferencian
por no compartir el 43% de las especies.
Otra agrupación la conforman las parcelas Peñas 2
y Redondo 2, las cuales se caracterizan por la ausencia de
THAIMELO, BULLPUNC y THAIBESE, de los cuales
THAIMELO y THAIBISE fueron de los más abundantes
en el conglomerado de las parcelas Peñas 3 y Redondo 1.
En las parcelas Peñas 2 y Redondo 2 fueron más abundantes
CANTRING, LITTASPE, BYSSAFFI y OPEAPSEU (47-64
individuos). Aunque ambas parcelas se diferencian por no
compartir el 57% de las especies.
El resto de las parcelas (Laminar 1, Laminar 2, Laminar 3 y Redondo
3) están agrupadas en el centro del aná-
lisis de conglomerado del eje X (Figura
4), caracterizándose por la ausencia de las
especies LEUCCERA y SCURMESO, de
las cuales la primera era una de las especies más abundante en el conglomerado
Peñas 3 y Redondo 1. Las especies más
abundantes en estas cuatro parcelas fueron
LITTASPE, ACARROST, NERISCAB y
PSEUCORR (46-58 individuos), aunque
las parcelas se diferencian por no compartir el 60% de las especies. Las especies
LITTASPE, ACARROST, NERISCAB
también fueron abundantes en la parcela
Peñas 1, pudiendo considerase cierta similaridad composiciónal entre Peñas 1 y este
último grupo de parcelas
Con lo anterior se demuestra que la composición
de las especies de macroinvertebrado no depende del tipo de
microhábitat formados por las rocas; más bien, podría depender de otros factores no medidos en este estudio, como por
ejemplo la distancia a la costa a la que se encuentre el cúmulo
de rocas, distribución en tiempo y espacio (Oigman-Pszczol,
Figueiredo y Creed, 2004), influencia de perturbaciones (Ricklefs, 2003), calidad del agua (Vaghela, Bhadja, Ramoliya,
Patel y Kundu, 2010); tomando en cuenta que los factores
que influyen la estructura de la comunidad de macroinvertebrados intermareales son varios y están interrelacionados
(Gray, 2000).
|
CONCLUSIONES
La diversidad de macroinvertebrados intermareales dentro
del área de muestreo está conformada por 30 especies y se
espera que se agreguen seis especies más a la lista al aumentarse el esfuerzo de muestreo. La diversidad desde el punto
de vista de riqueza de especie y abundancia fue muy diferente
entre los microhábitats, siendo las Peñas el más rico y abundante.
A pesar de las diferencias en los parámetros de diversidad (riqueza y abundancia), la composición de especies
comparada entre los tres microhábitats no mostró diferencias
significativas, por lo que se descartó una asociación entre los
microhábitats y la composición de especie.
Las diferencias más bien estriban de parcela a parcela, sugiriendo que otros factores (bióticos o abióticos) no
tomados en cuenta en este estudio pueden estar influyendo
de una forma localizada en las diferencias composicionales.
|
REFERENCIAS BIBLIOGRÁFICAS
Borcard, D., Gillet, F. y Legendre, P. (2011). Numerical Ecology with R. New York. USA. Springer.
Crowe, T., Thompson, R. C., Bray, S., y Hawkins, S. J. (2000). Impacts of anthropogenic stress on rocky intertidal communities. Journal
of Aquatic Ecosystem Stress and Recovery. 7 (4). p. 273-297.
Gray, J. (2000). Themeasuremen to marine species diversity, with an application to the benthic fauna of the Norwegian continental
shelf. Journal of Experimental Marine Biology and Ecology. 250 (1). p. 23-49.
Guevara, Z., López, A. y Pérez, M. (1997). Gran Reserva Biológica de Bosawas: Inventario preliminar de la fauna malacológica. Revista Encuentro. 3 (43). p. 61-66.
Holdridge, L.R. (1978). Ecología basada en zonas de vida. Instituto Interamericano. Ciencias Agrícolas, San José, Costa Rica. p. 216
Ikomi, R. B., Arimoro, F. O., y Odihirin, O. K. (2005). Composition, distribution and abundance of macroinvertebrates of the upper
reaches of River Ethiope Delta State Nigeria. The Zoologist. 3. p. 68–81.
Kolde, R. (2018). Pretty Heatmaps. Version 1.0.12. Available at CRAN repository, R.
Magurran, A. (2004). Measuring Biological Diversity. Blackwell Publishing.
MARENA (Ministerio de Recursos Naturales y del Ambiente, NI). (2002). Plan de Manejo Reserva de Vida Silvestre Río Escalante
Chacocente. Managua, Nicaragua. p. 89.
MARENA (Ministerio de Recursos Naturales y del Ambiente, NI). (1999). Lista de un estudio de país. Dirección General de Biodiversidad y Recursos Naturales. Programa Ambiental de Nicaragua. Managua, Nicaragua.
McCune, B. y Grace, J. B. (2002). Analysis of Ecological Assemblages. MjM Software Design, Gleneden Beach, Oregon.
Oigman-Pszczol, S., Figueiredo, M. y Creed, J. (2004). Distribution of benthic communities on the tropical rocky subtidal of Armação
dos Búzios, Southeastern Brazil, Marine Ecology, 25 (3), 173-190. Recuperado de https://onlinelibrary.wiley.com/doi/epdf/10.1111
/j.1439-0485.2004.00018.x
Oksanen, J., Guillaume, F., Friendly, M., Kindt, R., Legendre, P., McGlinn, D.,…Wagner, H. (2018). Community Ecology Package
“vegan”. Version 2.5-2. Avaiblable at CRAN repository, R.
Pérez, A. M y López, A. (2002). Atlas de moluscos Gasterópodos Continentales del pacifico de Nicaragua. Centro de Malacología y
Diversidad Animal, UCA. Managua, Nicaragua.
Pérez, A. M., Sotelo, M. y Arana, I. (2004). Variación altitudinal de la diversidad en comunidades de gasterópodos del Volcán Maderas,
Isla de Ometepe, Nicaragua.
Pérez, A. M., Sotelo, M., Gámez, J., Aburto, L. y Siria, I. (2007). Informe final de biodiversidad: Composición y riqueza de aves, moluscos y plantas asociadas con sistemas silvopastoriles de Matiguás y Río Blanco, Departamento de Matagalpa, Nicaragua.
Ricklefs, R. E. (2003). A Economia da Natureza. Rio de Janeiro, Guanabara Koogan.
Ripley B., Venables, B., Bates, D., Hornik, K., Gebhardt, A. y Firth, D. (2018). Support Functions and Datasets for Venables and Ripley’s MASS. Version 7.3-50. Avaiblable at CRAN repository, R
Trott, T. J. s.f. Intertidal biodiversity in the Gulf of Maine: Detecting Patterns of diversity and change. Census of Marine Life, Gulf of
Maine Area Program, Final Report.
Vaghela, A., Bhadja, P., Ramoliya, J., Patel, N, y Kundu, R. (2010). Seasonal variations in the water quality, diversity and population
ecology of intertidal macrofauna at an industrially influenced coast. Water Science and Technology, 61 (6). p. 1505–1514.
|
Recibido: 23 de mayo del 2019
Aceptado: 15 de junio del 2019
|
 |