



Ciencia de las Plantas
Respuesta al estrés hídrico y a la defoliación de la leguminosa forrajera Calopogonium mucunoides Desv según zona de procedencia
Response to water stress and defoliation of the forage legume Calopogonium mucunoides Desv according to area of origin
La Calera
Universidad Nacional Agraria, Nicaragua
ISSN: 1998-7846
ISSN-e: 1998-8850
Periodicidad: Semestral
vol. 21, núm. 37, 2021
Recepción: 06 Septiembre 2021
Aprobación: 20 Octubre 2021

Resumen: El principal recurso limitante en la sequía es el agua, en consecuencia, este recurso junto con otros factores edafoclimáticos afecta varios aspectos de crecimiento y desarrollo de los individuos. En este estudio, se evaluó la tolerancia al estrés hídrico y el crecimiento compensatorio de la leguminosa forrajera conocida como Calopo o Rabo de Iguana (Calopogonium mucunoides Desv) de dos procedencias; sometidas a defoliación y a déficit hídrico. En condiciones controladas de invernadero se realizó el experimento con arreglo factorial de ocho tratamientos con tres repeticiones. Los individuos de C. muconoides fueron sometidos a dos niveles de defoliación: plantas defoliadas cada quince días y plantas no defoliadas; así como dos niveles de régimen hídrico: plantas regadas cada dos días y planta regadas cada siete días; se usaron plantas procedentes de dos comunidades: Muy Muy y Rivas. Las variables evaluadas fueron biomasa aérea, biomasa de raíces, biomasa total, tasa de crecimiento relativo, potencial hídrico y conductancia estomática. Se utilizó un modelo lineal mixto ajustado por máxima verosimilitud restringida. Todos los análisis estadísticos se realizaron con el software estadístico R. Los resultados muestran una respuesta diferenciada y compleja en las características de producción de biomasa y fisiológicas de las procedencias de C. mucunoides ante el efecto combinado de la defoliación y el régimen hídrico. Las plantas defoliadas y de procedencia de Muy Muy presentaron un mayor crecimiento compensatorio en comparación a las plantas de Rivas. Hubo una disminución en el potencial hídrico y la conductancia estomática en plantas defoliadas y con estrés hídrico. En las condiciones de estudio la especie de C. mucunoides es tolerante a la defoliación y al estrés hídrico
Palabras clave: pastos, leguminosas, producción de biomasa, tasa de crecimiento relativo.
Abstract: The main limiting resource in drought is water. Consequently, this resource along with other edaphoclimatic factors affect various aspects of growth and development of individuals. In this study, were evaluated drought tolerance and compensatory growth of Calopogonium mucunoides Desv from two different provenances; subjected to defoliation and water deficit. In controlled greenhouse conditions, an experiment was carried out with a factorial arrangement of eight treatment combinations with three replicates each. Individuals of C. muconoides were subjected to two levels of defoliation: defoliated plants every fifteen days vs non-defoliated plants; two levels of water regime: plants watered every two days vs plant watered every seven days, using plants from: Muy Muy and Rivas. The variables evaluated were aerial biomass, root biomass, total biomass, relative growth rate, water potential and stomatal conductance. A linear mixed model adjusted by restricted maximum likelihood was used. All statistical analyzes were performed with the R statistical software. The results show a differentiated and complex response in the biomass production and physiological characteristics of the C. mucunoides provenances to the combined effect of defoliation and the water regime. The defoliated plants and plants from Muy Muy presented a higher compensatory growth compared to the Rivas plants. There was a decrease in the water potential and stomatal conductance in defoliated plants and with water stress. Under the study conditions, the C. mucunoides species is tolerant to defoliation and water stress.
Keywords: Pastures, legumes, biomass production, relative growth rate.
El principal recurso limitante en la sequía es el agua. En consecuencia, este recurso junto con otros factores edafoclimáticos afectan varios aspectos de crecimiento y desarrollo de los individuos (Hooke y Sandercock, 2017), incluyendo la germinación, el desarrollo de rebrotes, raíces y fotosíntesis. Debido al cambio climático y su variabilidad (Grupo Intergubernamental de Expertos sobre el Cambio Climático [IPCC], 2014) la sequía se ha convertido en uno de los fenómenos impredecibles y provoca efectos adversos en las especies de leguminosas (Basu et al., 2016).
La especie Calopogonium mucunoides Desv, conocida por su nombre común como Calopo o Rabo de Iguana, es una leguminosa forrajera tropical originaria de América tropical y del oeste de la Indias Occidentales (Carballo et al., 2005) con cierta tolerancia a la sequía (Garcia et al., 2013). Se adapta a un alto rango de condiciones de suelos, siendo mejor los de textura arcillosos con pH entre 4.5 – 5.0, no tolera la salinidad, pero si encharcamiento prolongado y sombra moderada (Peters et al., 2011).
En este sentido, las plantas han desarrollado mecanismos de tolerancia a la sequía tal como: escape y evitación, acumulación de solutos, regulación antioxidante y hormonal (Nadeem et al., 2019). Las leguminosas pueden escapar de la sequía a través de mayores potenciales hídricos lo que permite mejorar la absorción de agua y reducir su perdida (Siddique et al., 1993). La acumulación de solutos es una estrategia fundamental para la osmoprotectora y ajuste osmótico. El mecanismo de osmoprotección se basa en la estrecha asociación de elementos no tóxicos con numerosos componentes de la célula, mientras que la regulación osmótica ayuda a mantener la turgencia mediante el contenido relativo de agua en las células (Majumdar et al., 2016).
Las hormonas de regulación tales como: giberelinas, citoquininas, auxinas y acido abscísico (ABA) controlan el crecimiento y el desarrollo de la planta. Estas hormonas están vinculadas con la tolerancia a la sequía. Por ejemplo, el aumento en el nivel de citoquininas bajo déficit hídrico en la savia del xilema, estimula la apertura estomática al disminuir su sensibilidad a ABA (Bielach et al., 2017).
Estudios realizados por Cyriac et al., (2018); Vignolio et al., (2005), Vignolio et al., (2002), muestran una tendencia sobre la evolución de las leguminosas a la tolerancia y escape a la sequía. En decir, las estrategias de tolerancia se han caracterizado por un ajuste osmótico, mayor contenido relativo de agua e identifican el potencial de solutos como predictor temprano de la tolerancia al estrés por sequía.
La defoliación estimula la producción de biomasa y aumento en las áreas foliares, mientras que el estrés por déficit hídrico disminuye su acumulación de biomasa y áreas foliares (Vignolio et al., 2005). El efecto combinado de los factores defoliación y estrés hídricos han sido poco estudiados en plantas y en especial C. mucunoides, no obstante, han sido estudiados de manera individual en otras leguminosas y gramíneas (Coughenour et al., 1990; Toft et al., 1995).
Los estudios que involucran características externas y fisiológicas son importantes, pues proporcionan información detallada del crecimiento vegetal (Valdson et al., 2010), su funcionamiento y afectaciones de diversos factores, por ejemplo: minerales, hormonas y genes.
A nivel global, es notorio que el clima ha cambiado, mostrando un incremento de las temperaturas, lo que conlleva a un aumento en la evapotranspiración potencial, junto con un discreto descenso en las precipitaciones, todo lo cual promueve importantes cambios en la fenología, metabolismo, necesidades hídricas, relaciones entre especies (IPCC, 2014). El objetivo de este estudio es evaluar la tolerancia al estrés hídrico y el crecimiento compensatorio de Calopogonium mucunoides Desv de dos procedencias distintas; sometidas a defoliación y déficit hídrico.
MATERIALES Y MÉTODOS
Colección de las plantas y condiciones de crecimiento
Se colectaron plantas de dos zonas edafoclimáticas e historia de uso de suelo diferentes. La zona de Muy Muy (municipio de del departamento de Matagalpa, en la zona central norte de Nicaragua) está ubicada entre las coordenadas 12°44'46,26" de latitud Norte y 085°38'50,04" de longitud Oeste. Es una zona de trópico semihúmedo; transición entre zona seca y zona húmeda (Holdridge, 1982). La pluviosidad promedio anual es de 1 547 mm y temperatura promedio anual de 24.3 °C a una altitud entre 300 y 400 msnm. La historia de uso de suelo es ganadera, lo que ha provocado cambios ecológicos y socioeconómicos en el uso de la tierra (O’Toole y Aguilar-Støen, 2013) .
La zona de Rivas (municipio del departamento de Rivas, en la zona Suroeste de Nicaragua) se encuentra entre las coordenadas 11°26'10,80" de latitud Norte y 085°50'14,49" de longitud Oeste. Es una zona de bosque seco tropical (Holdridge, 1982). El Instituto Nicaragüense de Estudios Territoriales (INETER, 2012) señala que esta zona presenta una pluviosidad promedio anual es de 1 400 mm y temperatura promedio de 27 °C y que está ubicado en el rango de altitud entre 100 y 200 msnm. La historia de uso de suelo es agrícola y ganadera (O’Toole y Aguilar-Støen, 2013). Muy Muy presenta un incide de aridez 0.016 y Rivas de 0.020; un 25 % superior a Rivas (Funes et al., 2019).
El experimento se realizó en condiciones controladas de invernadero, con temperaturas promedias de 28 °C y humedad relativa del 30 %. El invernadero se encuentra ubicado en la Estación Experimental para el Estudio del Trópico Seco “El Limón” a 1.5 kilómetros al suroeste del municipio de Estelí, entre las coordenadas 13°03'02.15" de latitud Norte y 86°21'44.80" de latitud Oeste. Esta propiedad pertenece a la Facultad Regional Multidisciplinaria de Estelí, Nicaragua.
Se utilizó sustrato franco arcilloso, con pH de 6.6 y contenido de materia orgánica igual a 4.88 %, nitrógeno de 0.24 %, fósforo 43.7 mg kg-1, potasio 0.832 cmol+ kg-1, calcio 23,389 cmol+ kg-1 y magnesio 6.652 cmol+ kg-1. Desde el momento que las plantas enteras enraizadas fueron extraídas del campo, los individuos fueron cultivados en idénticas condiciones durante un mes antes del comienzo del experimento, tiempo de climatización en el invernadero. Previo al inicio del experimento se realizó un corte de homogenización.
Las plantas de ambas procedencias fueron cultivadas por reproducción vegetativa, en bolsas de polietileno de 31 cm de altura por 40 cm de diámetro con drenaje basal, con una edad promedio de tres meses y tamaño promedio de 15 cm.
Diseño experimental y manejo de tratamiento
Se utilizó un diseño completamente al azar con arreglo factorial de tratamientos, donde los factores evaluados fueron defoliación con dos niveles (sin corte y corte cada 15 días), régimen hídrico con dos niveles (irrigación a capacidad de campo cada dos días e irrigación a capacidad de campo cada siete días) y procedencia con dos niveles (Rivas y Muy Muy). Los niveles de los factores se organizaron ortogonalmente. Para cada combinación de tratamientos (defoliación × régimen hídrico × procedencia), en el caso de la tasa de crecimiento relativo, se usaron tres repeticiones, cada una con diez macetas para un total de 240 macetas.
La defoliación de plantas se realizó con tijeras a una altura aproximadamente de 1.5 cm respecto al nivel del sustrato. Para la determinación del régimen hídrico, las macetas de polietileno fueron llevadas a capacidad de campo donde se estableció una dosis de agua equivalente a 300 ml maceta-1 día-1, que permitía un buen estado de hidratación y evitaba la asfixia radicular. La duración del experimento fue de 120 días.
Variables de respuestas
Producción de materia seca por planta. Todo el material vegetativo se cosechó y almacenó al finalizar el experimento. Por lo tanto, la biomasa se colectó en bolsas de papel las que fueron llevadas al laboratorio y colocadas en una estufa a 70 ºC, hasta obtener un peso constante (72 horas). Posteriormente se separó en biomasa aérea (g): peso seco aéreo incluyendo macollos vegetativos y reproductivos; biomasa de raíces (g): peso seco de raíces (g); biomasa total acumulada (g): incluida la biomasa aérea y biomasa de raíz. Cada uno de los componentes fue pesado en balanza digital de precisión obteniendo el peso en gramos de materia seca (gMS). Estas variables están basadas en los protocolos estandarizados propuesto por Pérez-Harguindeguy et al., (2013).
Tasa de crecimiento relativo (TCR). El crecimiento compensatorio (sobrecompensación, compensación exacta y sub compensación) se evaluó a través de la TCR utilizando la fórmula de Hoffmann y Poorter (2002).
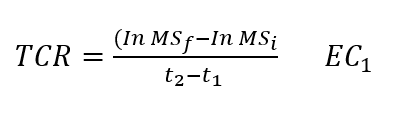
Donde ln MSf y ln MSi son los promedios del logaritmo natural de la materia seca (g) final e inicial, respectivamente, y t2 – t1 es la diferencia de tiempo (días) entre dos cortes sucesivos.
Potencial hídrico. Para medir el potencial hídrico (MPa) se utilizó una bomba de presión Scholander Modelo 3005, SoilMoisture Equipment Corp., Santa Barbara, CA, USA. Las mediciones se realizaron en hojas, entre las 10:00 h y las 14:00 h (Pérez-Harguindeguy et al., 2013), a los 60 días y 120 días después de haber iniciado el experimento. Las mediciones fueron en tres hojas seleccionadas aleatoriamente, usando tres repeticiones por tratamientos y colectadas en dos momentos durante el experimento para un total de 144 hojas.
Conductancia estomática. Para medir de la conductancia estomática (µMol m2) se utilizó un porómetro marca Li-Cor® serie Li-1600. Las mediciones fueron en tres hojas seleccionadas aleatoriamente, usando tres repeticiones por tratamientos (Pérez-Harguindeguy et al., 2013) a los 30, 90 y 120 días después de iniciado el experimento para un total de 216 hojas.
Análisis estadístico
Para conocer el efecto de la defoliación, el régimen hídrico y del lugar de procedencia sobre las características morfológicas y fisiológicas de las plantas, se utilizó un modelo lineal mixto ajustado por máxima verosimilitud restringida. En todos los casos, la defoliación, el régimen hídrico y la procedencia fueron considerados como factores fijos y la maceta como factor de efecto aleatorio. Se utilizó adicionalmente el tiempo como factor fijo cuando se modeló la conductancia estomática y el potencial hídrico. El modelo completo consistió en el ajuste de efectos principales e interacciones de segundo orden de los factores antes mencionados. Después del ajuste del modelo, se realizó análisis de residuales para detectar violaciones a los supuestos de homocedasticidad y normalidad por medio de inspección visual de gráficos. Para remediar las violaciones a los supuestos anteriores, se incluyó en cada modelo una estructura de función de varianza que permitió diferentes varianzas por estrato.
En todos los casos, después de ajustar el modelo completo, los términos no significativos fueron removidos paso a paso y los sub-modelos fueron comparados usando la prueba de razón de verosimilitud y el criterio de información de Akaike (AIC) como medida para comparar el ajuste de los diferentes modelos. El modelo con AIC más bajo se consideró el modelo más parsimonioso.
Fueron realizadas comparaciones múltiples usando la prueba de Tukey. Todos los análisis fueron realizados con el software estadístico R (Suhl et al., 2014).
RESULTADOS Y DISCUSION
Producción de materia seca por planta
El efecto de la defoliación en la acumulación de biomasa aérea varía según el régimen hídrico (p=0.001) (Figura 1a). Las plantas defoliadas soportaron mejor el estrés hídrico produciendo una mayor biomasa aérea (p<0.001) en comparación con las plantas no defoliadas. Igualmente, el efecto de la defoliación sobre la biomasa aérea depende de la procedencia de las plantas (p=0.001) (Figura 1b). Así, las plantas de procedencia de Muy Muy respondieron mejor cuando fueron defoliadas respecto de su control no defoliado (p<0.001). También, la respuesta de las plantas al régimen hídrico varía según su procedencia (p=0.002) (Figura 1c), mostrando un mayor efecto en plantas de procedencia de Muy Muy sin estrés hídrico con respecto aquellas con estrés hídrico (p<0.001).
En este estudio se muestran que C. mucunoides tiene una capacidad media para compensar la defoliación, tolerar el estrés y adaptarse a zonas secas. Es así, que plantas defoliadas favoreció la acumulación de biomasa aérea, estimulo el crecimiento de nuevos rebrotes, así como la distribución de recursos. Estos son procesos compensatorios de los individuos para disminuir el daño causado por la defoliación o por los niveles de herbívora (Strauss y Agrawal, 1999). Similares resultados encontraron (Striker et al., 2008) donde la defoliación no afectó la recuperación de leguminosa Lotus tenuis y creó resistencia a la defoliación (Miranda et al., 2003). Por lo tanto, C mucunoides es una especie que tolerara el estrés hídrico por reducción de biomasa foliar y por tanto por reducción total de pérdida de agua por transpiración (Pizarro y Carvalho, 1996).
Según Peters et al. (2011), C mucunoides se ha adapta en zonas húmedas desde los 1 000 msnm hasta los 2 000 msnm, sin embargo, en este estudio la especie presenta una adaptación moderada en zonas más secas, como es el caso de las plantas procedentes de Rivas.
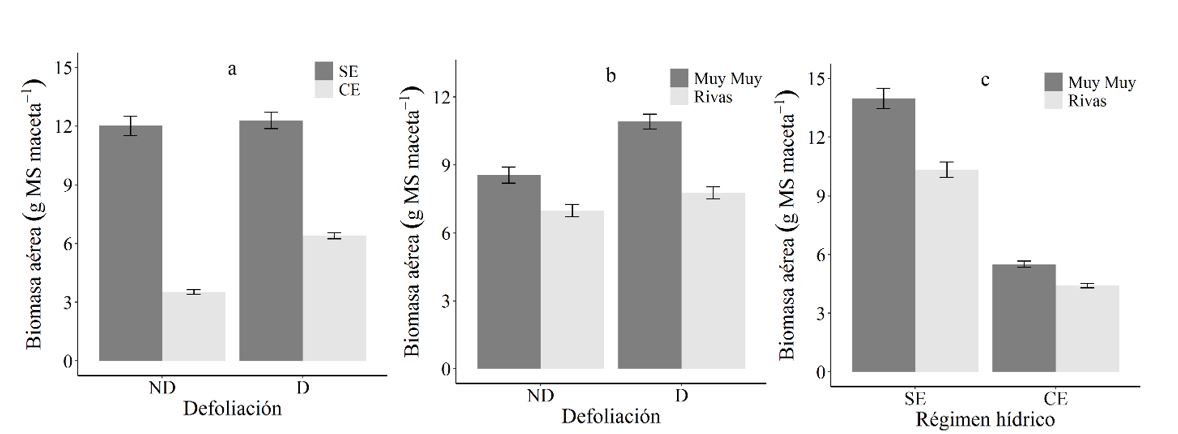
ND: no defoliadas, D: defoliadas, SE: sin estrés, CE: con estrés. Las barras representan el error estándar 5 %.
El efecto de la defoliación sobre la biomasa radicular está en dependencia del régimen hídrico evaluado (p<0.001) (Figura 2a). Así, la reducción en la biomasa de raíces es más marcada en plantas sometidas a estrés hídrico cuando no fueron defoliadas en comparación con aquellas defoliadas (p=0.001). De la misma manera, el efecto del régimen hídrico sobre la biomasa radicular varía según la procedencia (p=0.011) (Figura 2b), de tal manera que las plantas de procedencia de Rivas respecto a las de Muy Muy, toleraron mejor cuando fueron sometidas a estrés hídrico en relación con aquellas sin estrés hídrico (p<0.001). Es notario los efectos diferenciados de las combinaciones de tratamientos aplicados, lo que puede estar asociado a una priorización por la planta para la recuperación de la parte aérea después que se han defoliados, reduciendo la asignación de biomasa para el sistema radicular (Briske y Richards, 1995).
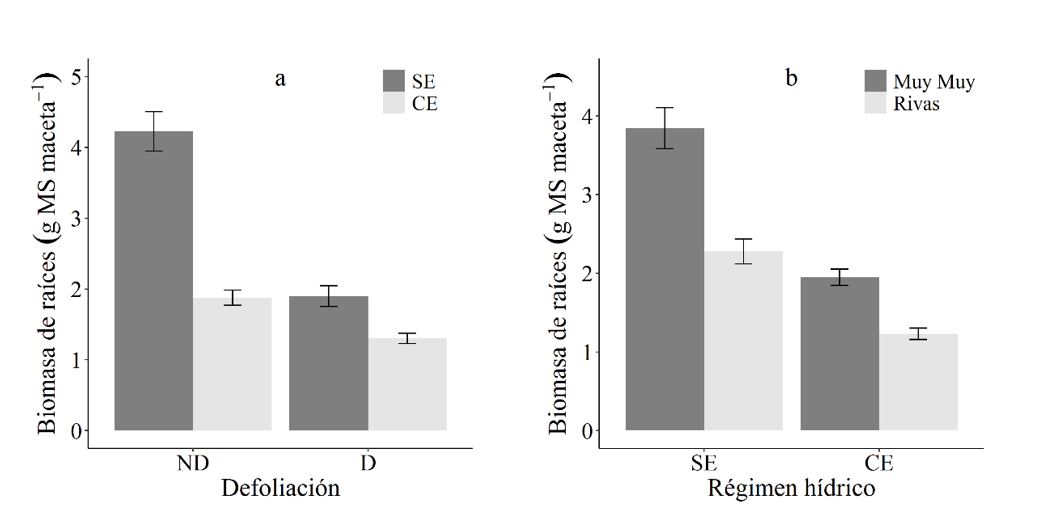
ND: no defoliadas, D: defoliadas, SE: sin estrés, CE: con estrés. Las barras representan el error estándar 5 %.
El efecto de la defoliación sobre la acumulación de la biomasa total en plantas de C. mucunoides varía según el régimen hídrico sometido (p<0.001) (Figura 3a). Como se observa, las plantas defoliadas toleraron mejor el estrés hídrico presentando mayor producción de biomasa total que aquellas no defoliadas (p<0.001). Adicionalmente, la respuesta de las procedencias varía según el régimen hídrico aplicado (p=0.001) (Figura 3b), mostrando mayor biomasa total cuando las plantas de ambas procedencias no fueron sometidas a estrés hídrico (p<0.001). Así mismo, el efecto de la defoliación está en dependencia de la procedencia de las plantas (p=0.004) (Figura 3c). Así, las plantas de procedencia de Muy Muy respondieron mejor cuando fueron defoliadas (p<0.001).
La biomasa total acumulada está influenciada por el efecto combinado de la defoliación, el régimen hídrico y la procedencia. Es así, que las plantas defoliadas y de Muy Muy toleran el estrés hídrico, mostrando una sub compensación en la tasa de crecimiento relativo. A pesar de que el estrés por disminución de agua afectó el crecimiento aéreo, radicular y total en todos los tratamientos, se observó una adaptación, ya que las plantas estresadas continuaron su crecimiento. Esta estrategia de supervivencia y adaptación se debe a que las plantas se han desarrollado evolutivamente tanto a nivel morfológico, anatómico y celular, lo que les permiten vivir en condiciones de constante estrés hídrico (Orcutt y Nilsen, 2001).
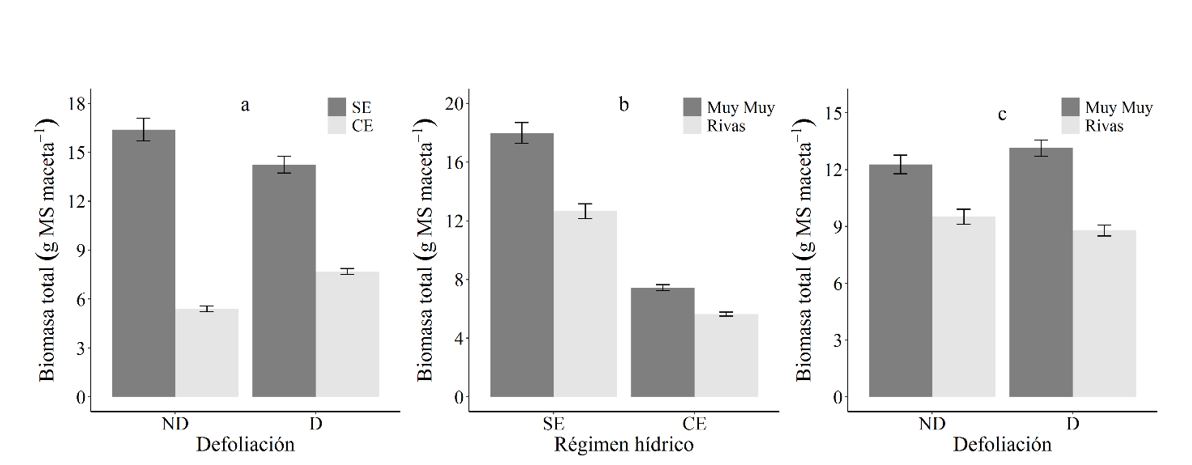
Tasa de crecimiento relativo (TCR)
El efecto de la defoliación sobre la tasa de crecimiento relativo está en dependencia del estrés hídrico (p=0.003) y la procedencia (p=0.019) (Figura 4a). Las plantas defoliadas y con estrés hídrico presentaron una sub compensación parcial en relación a las plantas sin estrés hídrico. Sin embargo, las plantas defoliadas y de la procedencia de Muy Muy mostraron una sobrecompensación, en relación con las plantas defoliadas de Rivas (Figura 4b). Los ecotipos favorecieron la tasa de crecimiento relativo. Las plantas de procedencia de Muy Muy mostraron mayor TCR en relación a las plantas de Rivas. La especie de C mucunoides se ha adaptado en ambientes húmedas (Peters et al., 2011) y en ambientes secos no es persistente.
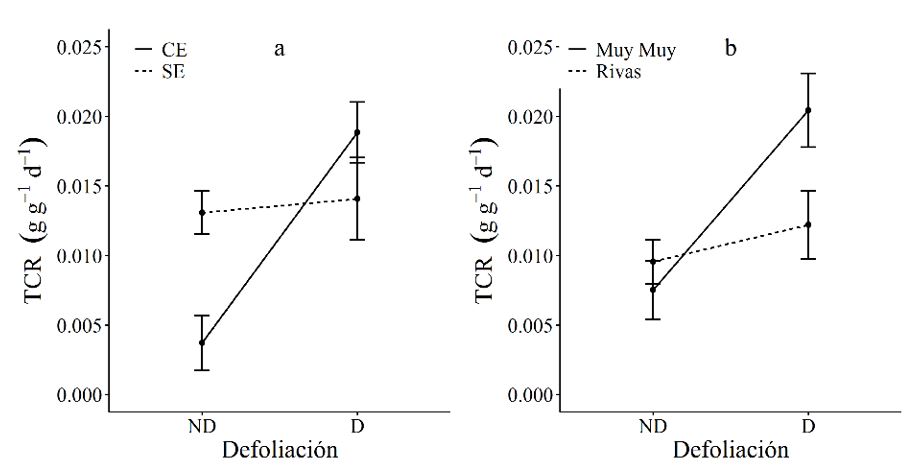
Potencial hídrico
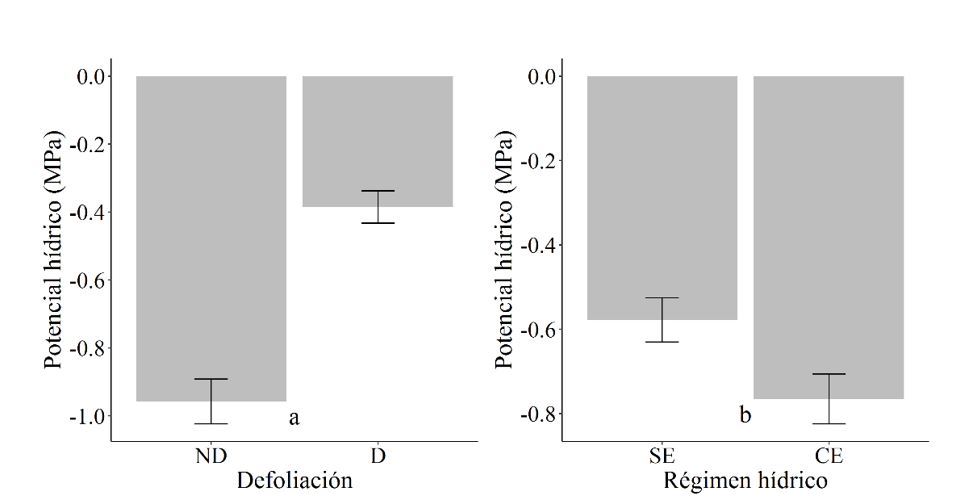
En la Figura 5a se observa que las plantas que fueron defoliadas presentaron disminución del potencial hídrico (-0.4 MPa) (p<0.001), al igual que las plantas sin estrés hídrico (p=0.017) (Figura 5b).
Conductancia estomática
El efecto de la defoliación sobre la conductancia estomática en plantas de C. mucunoides varía según el régimen hídrico (p=0.001) (Figura 6a), presentando las plantas defoliadas valores más elevados que aquellas no defoliadas, y las estresadas valores menores a las regadas con alta frecuencia. Es decir, la defoliación provoca menores valores de conductancia estomática en plantas sin estrés hídrico (p=0.007). Adicionalmente, la respuesta de las procedencias está en dependencia del tiempo (p<0.001). Así, en la primera etapa del estudio las plantas de procedencia de Rivas presentaron mayores valores de conductancia estomática que las de procedencia Muy Muy (p=0.001) (Figura 6b), sin embargo, las plantas de ambas procedencias se comportaron de manera similar en la segunda etapa.
Los resultados en este estudio coinciden con los reportados por Vignolio et al., (2005), quienes indican que las especies de leguminosas son tolerantes al estrés hídrico. Es así, que estas respuestas de las plantas son atribuidas a las características de la especie, así como a los ajustes osmóticos y estomáticos (Utrillas y Alegre, 1997; Vignolio et al., 2002). Este ajuste, consiste en una disminución del potencial hídrico en los tejidos vegetales, lo cual tiene como consecuencia la entrada de agua y, por tanto, no se presenta una disminución en la productividad fotosintética. El ajuste osmótico se da en las plantas a través una estimulación de la acumulación de iones inorgánicos, o mediante un aumento en los niveles de solutos orgánicos. Tal ajuste osmótico u osmorregulación puede impedir la pérdida de turgencia de la raíz (Azcón-Bieto y Talón, 2003). Otro mecanismo de resistencia a nivel fisiológico es el cierre de estomas, ya que estos son los responsables de la mayor proporción de pérdida de agua en las plantas (Taiz y Zeiger, 2006).
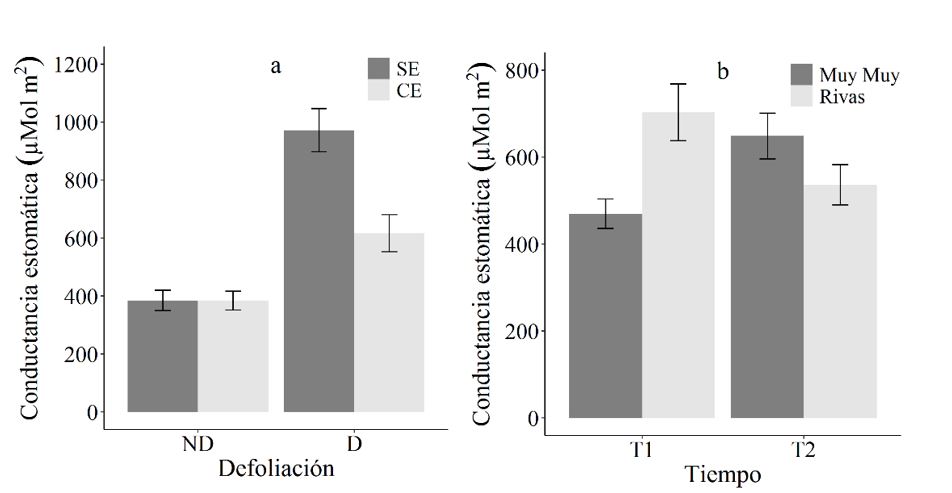
ND: no defoliadas, D: defoliadas, T1: tiempo 1, T2: tiempo 2. Las barras representan el error estándar 5 %.
CONCLUSIÓN
La especie Calopo o Rabo de Iguana (Calopogonium mucunoides Desv) es tolerante a la defoliación y al estrés hídrico. Por consiguiente, la defoliación favoreció la tasa de crecimiento relativo en plantas de procedencia de Muy Muy y provocó una disminución en plantas de procedencias de Rivas.
Agradecimientos
Los autores agradecen al Centro tecnológico Santiago Baldovino (INATEC) de Muy Muy, Matagalpa y a la Universidad Internacional Antonio de Valdivieso (UNIAV), por haber facilitado el material vegetativo del experimento. Este estudio, fue posible por el financiamiento de un contrato de beca de fondos para proyectos de investigación (FPI) de la Universidad Nacional Autónoma de Nicaragua (UNAN Managua).
A la Agencia Española de Cooperación Internacional para el Desarrollo (AECI) por la construcción de la Estación Experimental de El Limón, que ahora cumple sus primeros 10 años de existencia y al convenio de colaboración de la Universidad Nacional Autónoma de Nicaragua, a través de la Facultad Regional Multidisciplinaria de Estelí (UNAN Managua / FAREM Estelí) y el Instituto de Investigación y Tecnología Agroalimentaria (IRTA-España)
Referencias
Azcón-Bieto, J., y Talón, M. (2003). Fundamentos de fisiología vegetal. McGrawHill.
Basu, S., Ramegowda, V., Kumar, A., y Pereira, A. (2016). Plant adaptation to drought stress. F1000Research, (5). https://doi.org/10.12688/f1000research.7678.1
Bielach, A., Hrtyan, M., y Tognetti, V. B. (2017). Plants under stress: Involvement of auxin and cytokinin. International Journal of Molecular Sciences, 18(7). https://doi.org/10.3390/ijms18071427
Briske, D. D., y Richards, J. H. (1995). Plant Responses To Defoliation: a Physiological, Morphological and Demographic Evaluation. https://agrilifecdn.tamu.edu/briske/files/2014/03/Briske-Richards-SRM-CHAPTER95.pdf
Carballo, D., Matus, M., Betancourt, M., y Ruiz, C. (2005). Manejo de pasto I. http://repositorio.una.edu.ni/2425/7/Manejo%20de%20pasto%20I.pdf
Coughenour, M. B., Detling, J. K., Bamberg, I. E., y Mugambi, M. M. (1990). Production and nitrogen responses of the African dwarf shrub Indigofera spinosa to defoliation and water limitation. Oecologia, 83(4). https://doi.org/10.1007/BF00317208
Cyriac, D., Hofmann, R. W., Stewart, A., Sathish, P., Winefield, C. S., y Moot, D. J. (2018). Intraspecific differences in long-term drought tolerance in perennial ryegrass. PLoS ONE, 13(4), 1–17. https://doi.org/10.1371/journal.pone.0194977
Funes, I., Savé, R., Rovira, P., Molowny-Horas, R., Alcañiz, J. M., Ascaso, E., Herms, I., Herrero, C., Boixadera, J., y Vayreda, J. (2019). Agricultural soil organic carbon stocks in the north-eastern Iberian Peninsula: Drivers and spatial variability. Science of the Total Environment, 668. https://doi.org/10.1016/j.scitotenv.2019.02.317
Garcia, M., Vigna, B. B. Z., Sousa, A. C. B., Jungmann, L., Fernanda, W., Toledo-silva, G., Francisco, P. M., Chiari, L., Marcelo, A., Karia, C. T., Faleiro, F. G., Godoy, R., Agnol, M. D., Sueli, S., Souza, F., Souza-chies, T., Jank, L., Rosangela, M. S., Valle, C., … Souza, A. P. (2013). Molecular genetic variability , population structure and mating system in tropical forages. Tropical Grasslands, 1(1), 25-30. https://doi.org/10.17138/tgft(1)25-30
Pérez-Harguindeguy, N., Díaz, S., Garnier, E., Lavorel, S., Poorter, H., Jaureguiberry, P., Bret-Harte, M. S., Cornwell, W. K., Craine, J. M., Gurvich, D. E., Urcelay, C., Veneklaas, E. J., Reich, P. B., Poorter, L., Wright, I. J., Ray, P., Enrico, L., Pausas, J. G., De Vos, A. C., … Cornelissen, J. H. C. (2013). New handbook for standardised measurement of plant functional traits worldwide. Australian Journal of Botany, 61(3), 167–234. https://doi.org/10.1071/BT12225
Hoffmann, W. A., y Poorter, H. (2002). Avoiding bias in calculations of relative growth rate. Annals of Botany, 80, 37–42. https://doi.org/10.1093/aob/mcf140
Holdridge, L. R. (1982). Ecología basada en zonas de vida. http://www.cct.or.cr/contenido/wp-content/uploads/2017/11/Ecologia-Basada-en-Zonas-de-Vida-Libro-IV.pdf
Hooke, J., y Sandercock, P. (2017). Combating desertification and land degradation: spatial strategies using vegetation. https://doi.org/10.1007/978-3-319-44451-2
Instituto Nicaragüense de Estudios Territoriales. (2012). Dirección General de Meteorología. https://www.ineter.gob.ni/met.html
Grupo Intergubernamental de Expertos sobre el Cambio Climático. (2014). Climate Change 2014: Mitigation of Climate Change. Cambridge University Press.
Majumdar, R., Barchi, B., Turlapati, S. A., Gagne, M., Minocha, R., Long, S., y Minocha, S. C. (2016). Glutamate, ornithine, arginine, proline, and polyamine metabolic interactions: The pathway is regulated at the post-transcriptional level. Frontiers in Plant Science, 7. https://doi.org/10.3389/fpls.2016.00078
Miranda, C. H. B., Vieira, A., y Cadisch, G. (2003). Determination of biological nitrogen fixation by the forage groundnut (Arachis spp.) using the 15N natural abundance technique. Revista Brasileira de Zootecnia, 32(6), 1859–1865. https://doi.org/10.1590/s1516-35982003000800008
Nadeem, M., Li, J., Yahya, M., Sher, A., Ma, C., Wang, X., y Qiu, L. (2019). Research Progress and Perspective on Drought Stress in Legumes: A Review. International Journal of Molecular Sciences, 20(10). https://doi.org/10.3390/ijms20102541
O’Toole, D., y Aguilar-Støen, M. (2013). Ecología histórica de la ganadería y usos de la tierra asociados en Muy Muy y Belén, Nicaragua. Agroforesteria En Las Américas, (50), 7–15.
Orcutt, D. M., y Nilsen, E. T. (2001). The physiology of plants under stress—soil and biotic factors. Annals of Botany, 87(6). https://doi.org/10.1006/anbo.2001.1401
Peters, M., Franco, L. H., Schmidt, A., y Hincapié, B. (2011). Especies forrajeras Multipropósito: Opciones para productores del trópico Americano. CIAT. http://ciat-library.ciat.cgiar.org/Forrajes_Tropicales/pdf/Books/Especies%20Forrajeras%20MultipropositoTropicoAmericano.pdf
Pizarro, E. A., Ramos, A.K.B., y Carvalho, M. A. (1996). Potencial forrajero y producción de semillas de accesiones de Calopogonium mucunoides preseleccionadas en el Cerrado brasileño. Pasturas tropicales, 18(2), 9–13. http://ciat-library.ciat.cgiar.org/articulos_ciat/PAST1822.pdf
Siddique, K. H. M., Walton, G. H., y Seymour, M. (1993). A Comparison of Seed Yields of Winter Grain Legumes in Western Australia. Australian Journal of Experimental Agriculture, 33(7). https://doi.org/10.1071/EA9930915
Strauss, S. Y., y Agrawal, A. A. (1999). The ecology and evolution of plant tolerance to herbivory. Trends in Ecology and Evolution, 14(5), 179–185. https://doi.org/10.1016/S0169-5347(98)01576-6
Striker, G. G., Insausti, P., y Grimoldi, A. A. (2008). Flooding effects on plants recovering from defoliation in Paspalum dilatatum and Lotus tenuis. Annals of Botany, 102(2), 247–254. https://doi.org/10.1093/aob/mcn083
Suhl, J. A., Chopra, P., Anderson, B. R., Bassell, G. J., y Warren, S. T. (2014). R: A Language and Environment for Statistical Computing.
Taiz, L., y Zeiger, E. (2006). Fisiología vegetal (Vol II) (III). Universitat Jaume I.
Toft, N., McNaughton, S., y Georgiadis, N. (1995). Effects of water stress and simulated grazing on leaf elongation and water relations of an East African grass, Eustachys paspaloides [native grasslands; wildlife effects. Australian Journal of Plant Physiology (Australia), 14(2), 211-226. https://doi.org/10.1071/PP9870211
Utrillas, M. J., y Alegre, L. (1997). Impact of water stress on leaf anatomy and ultrastructure in Cynodon dactylon (L.) Pers. Under natural conditions. International Journal of Plant Sciences, 158(3). https://doi.org/10.1086/297443
Valdson, J. da S., Junior, J. C. B. D., Teixeira, V. I., Santos, M. V. F. dos, Lira, M. de A., y Mello, A. C. L. de. (2010). Características morfológicas e produtivas de leguminosas forrageiras tropicais submetidas a duas frequências de corte Morphologic and productive characteristics of tropical forage legumes under two harvest frequencies. Revista Brasileira de Zootecnia, 39(1), 97–102. https://www.scielo.br/j/rbz/a/By9w77RQYdQz8BZmpWKJmQy/?lang=pt&format=pdf
Vignolio, O., Biel, C., De Herralde, F., Savé, R., Araújo-Alves, y P.L., J. (2005). Use of water-stress tolerant Lotus creticus and Cynodon dactylon in soil revegetation on different slopes in a Mediterranean climate. Annales Botanici Fennici, 42(3), 195–205.
Vignolio, O. R., Biel, C., De Herralde, F., Araújo-Alves, J. P. L., y Savé, R. (2002). Growth of Lotus creticus creticus and Cynodon dactylon under two levels of irrigation. Australian Journal of Agricultural Research, 53(12). https://doi.org/10.1071/AR02033
Notas de autor

